在线客服
在线客服
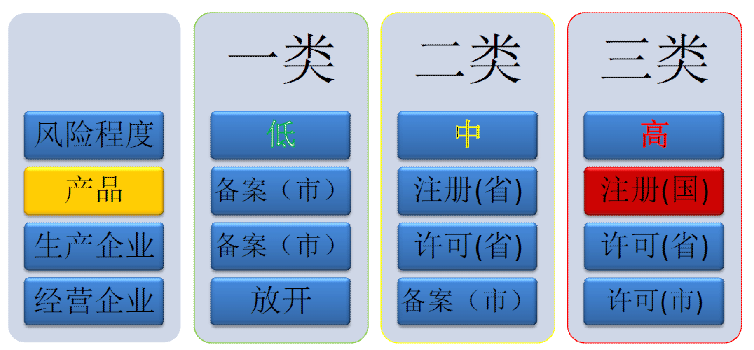
国内医疗器械注册分类管理,一张图告诉你!当产品被归类为中等复杂时,申请人认为其产品符合豁免标准,并可向FDA提交CLIA WAIVER申请。关于CLIA WAIVER申请,FDA有相关的指导文件。有兴趣的朋友可以查阅,不会在这里重复。指南名称是:ApplicationStudies对双510(k)和CLIA豁免的建议。
附录1记分卡标准(42 CFR 493.17)
记分卡分为7个测试,每个测试分为3个分数:1、 2、 3. 1是最低复杂度,3是最复杂的。测试后,将七个测试的分数加在一起。 12级及以下的级别是中度复杂的测试,12级以上的测试是非常复杂的测试。当特定测试的特征在描述的1到3之间时,该值被指定为2。
(1)国内医疗器械注册知识
(i)1分:(A)需要最少的科学和技术知识。 (B)可以通过工作描述获得操作所需的知识。
(ii)3分:在检查分析之前、分析、分析后需要专业知识。
(2)国内医疗器械注册培训和经验
(i)1分:(A)在分析、分析和分析后训练之前需要最少的训练。 (B)需要有限的经验
(ii)3分:(A)需要专业培训才能在、分析之前完成分析、分析后操作或(B)保证检测性能需要丰富的经验
国内医疗器械注册周期
- I类当场备案,但是现在大部分城市的药监局需备案者网上递交,通过初审才能去现场递交,无形中拉长了I类备案的时间。
- II类,93个工作日,这个只是药监局官方给的评审时间,且提交资料符合要求的情况下,如果资料不符合要求,会要求增补,周期会加长。
- III类,123个工作日,同样的,这是官方公布的初次评审的时间周期,根据具体的项目情况,注册周期会增加。
国内医疗器械注册费用
产I类不收取费用;
国产II类8-9万,各地药监局收费标准稍有不同;
国产III类15.36万;
进口I类不收取费用;
进口II类21.09万;
进口III类30.88万。
3月1日,国家药品监督管理局附条件批准安徽智飞龙科马生物制药有限公司的重组新型冠状病毒蛋白疫苗(CHO细胞)上市注册申请。该疫苗是首个获批的......
国家药监局 国家卫生健康委关于发布定制式医疗器械监督管理规定(试行)的公告(2019年 第53号)......
国家药监局局长焦红在中国医药创新发展大会上表示:“积极推动新修订的《药品管理法》和《医疗器械监督管理条例》年内出台,加快配套规章制修订,为各......
......
......
近日,国家药监局发布了《关于试点启用医疗器械电子注册证的公告》(以下简称《公告》),决定在试点发放医疗器械电子注册证。其中明确指出,试点......
为加强医疗器械生产监管,保障医疗器械安全有效,根据《医疗器械监督管理条例》第三十五条第二款规定,国家药品监督管理局组织修订了《医疗器械质量管......
据近日俄罗斯《消息报》报道,俄罗斯托木斯克工业大学科研人员,把聚乙内酯放入磁控管放电等离子体中进行处理,研发出一种能更好地治疗急性血栓的新型......
我国医疗器械共有三类,其中,三类医疗器械属于高危风险类产品,在生产经营上都有严格的管控措施。下面有这一起案例,余姚市市场监管部门工作人员对某......
......