在线客服
在线客服
我国对医疗器械采用上市前审批和上市后监管的方式来保证产品的安全性。按照我国的医疗器械监管法规,在我国境内销售、使用的医疗器械均应进行注册,医疗器械注册主要包括注册检验、临床试验、注册审批、质量体系核查等必经环节,这些环节也是监管过程中至关重要的关键环节。
一、我国医疗器械注册现状与痛点
近年来,随着医疗器械法规的不断完善,国家对医疗器械注册的审评越来越严,对医疗器械企业的研发能力和生产能力要求越来越高,企业的投入也越来越大,企业要想尽早获得利润,就需要尽快注册上市,才能有资质正常销售。所以医疗器械注册的快慢直接影响着医疗器械企业在市场上的竞争力和市场占有率。
然而,企业在医疗器械注册过程中仍然存在着很多问题,如注册检验过程中排队时间长、注检项目无法一次性通过,临床试验周期长、花费大,注册审批速度慢等,这些都是导致产品无法快速上市的因素,从而不利于医疗器械产品的创新和产业的发展。对于注册过程中的关键环节,存在着如下现状与痛点:
1注册检验
注册检验是产品上市前评价的第一个主要环节,生产企业在申请注册检验前,应选择具有医疗器械检验资质、在其承检范围内的医疗器械检验机构。
目前,各省(自治区、直辖市)均设立了相应的医疗器械检验机构,其分布与当地医疗器械产业发展状况紧密相关。医疗器械产业发达的省份,其检验机构能力较强,数量也相对较多于欠发达地区;欠发达地区医疗器械生产企业数量少、规模小,检验机构的数量和认可能力项目也都相对较少,从而导致相对发达的省市,注检机构“门庭若市”,企业注检排队甚至超过半年以上,而相对欠发达的省市,注检机构“门可罗雀”,也造成一定程度的资源浪费。
另外,对于企业注检项目而言,由于检验项目繁多,在检验过程中就会出现无法一次性通过验证的情况,对于无法通过检验的项目,需要企业进行反复整改,直到整改通过后方可获取注检报告,这样就大大增加了企业的注检时间,影响企业注册上市。
2临床试验
临床试验是验证医疗器械上市前安全性和有效性的核心方法之一,也是影响注册审批速度的关键环节之一。临床试验一般是申办方(即企业)、实施者(即临床机构)及服务方(CRO服务等)共同完成,目前,医疗器械的临床试验实施者和临床机构都须按照《医疗器械临床试验规定》进行临床试验,在此期间,他们对医疗器械临床试验的管理、维护受试者权益、保证临床试验结果真实可靠起到了一定的作用[3]。
但在执行过程中,由于法规制度不够完善、申办者和研究者不够重视、临床试验质量不高等现象,致使临床试验过程中存在很多问题和不足,例如标准操作规程(SOP)不完善、对数据的可靠性没有进行核查、对数据进行造假、试验方案设计不合理、评价标准不规范、资料文件存放与管理不规范等,都有可能对临床试验的安全性、有效性造成影响[4],最终导致注册审批无法通过。
3注册审批
注册审批是对拟上市的医疗器械的安全性和有效性研究及其结果进行系统评价、判定风险受益比的过程,包括注册申报资料、技术审评、质量管理体系核查等环节,同样在注册审批过程中也同样遇到很多问题,例如在申请注册时一般都会遇到提交产品补充材料的情况,严重影响了注册审批效率,也影响了企业创新的积极性,由于资料的不完善甚至资料的不合规都有可能造成退审而无法注册,都将会给企业带来一定的经济困难,影响企业正常运作。
另外按照法律规定,第三类器械都要在国家药监局进行注册审批,这就会出现拥挤排队,超过法规规定的审批时限,从而给企业造成难以挽回的生产和销售混乱,尤其是在产品申请重新注册时。
注册审批过程中的质量体系核查也是影响企业上市的一个风险点,具体而言,就是对申请产品样品的研制、生产、检验、仓储等管理情况进行核查,进而判断该企业的质量管理体系可否有效分析并控制产品质量风险,进而得到企业申请产品样品真实、客观、可靠结论。但从核查情况看,医疗器械注册核查几乎没有一次性通过的,原因在于存在多种缺陷,包括生产机构及人员、产品开发、生产设施设备、生产管理、生产质量控制及文件管理等方面的缺陷。
二、医疗器械注册流程分析
医疗器械企业前期大都注重研发,而忽略了体系建设,由于资金的原因,也很少配置自己的注册团队,致使企业在注册过程中常存在着业务不熟悉、流程不清晰、人员不专业等问题,审批过程中就会出现不停补充、修改资料等情况,甚至造成注册申请被退回,耽误产品上市时间,给企业造成巨大的损失。
我国医疗器械产品分类,根据《医疗器械分类目录》,我国医疗器械产品分三大类管理。其中,第一类是指,通过常规管理足以保证其安全性、有效性的医疗器械。第二类是指,对其安全性、有效性应当加以控制的医疗器械。第三类是指,植入人体;用于支持、维持生命;对人体具有潜在危险,对其安全性、有效性必须严格控制的医疗器械。

以第三类医疗器械注册过程中的注册审批流程为例,分析企业所需的注册时间:
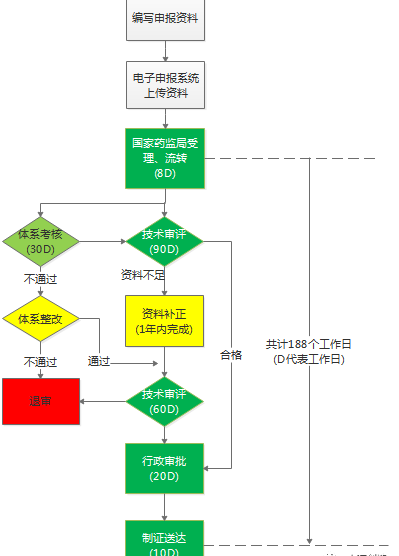
上图:第三类医疗器械注册审批流程
根据《医疗器械注册管理办法》,按照正常流程,第三类医疗器械注册审批所需时间至少为188个工作日(即约10个月时间),但考虑到一年内资料补正期的资料补正时间、体系审核整改时间、外聘专家评审时间等因素,企业仅仅在注册审批环节所需的时间就大约要一年半甚至更久。因此注册审批周期过长、效率低,进而给企业带来巨大的经济压力,严重影响了产品的快速上市,也是企业迫切渴望解决的问题之一。
三、大数据及AI技术助力医疗器械注册提速
基于以上现状,医疗器械企业为了加快注册,通常都会寻找注册服务机构,然而在寻找过程中,同样遇到各种问题:
(1) 注册服务机构的服务质量参差不齐、各自擅长的领域不一、无法找到合适的服务机构;
(2) 器械企业在寻找过程中不仅花费了大量的时间和精力,而且不专业的服务可能致使注册失败,服务机构也可能推诿扯皮,给企业造成更大的损失;
(3) 医疗器械注册涉及器械企业的机密信息,器械企业很害怕选择了不正规的注册服务机构,泄露信息;
(4) 对于服务机构而言,每年要花费大量的运营成本进行寻客,且效果并不十分理想。
因此传统模式已经无法满足医疗器械注册加速的需求,对于企业和服务机构而言,都迫切需要一个专业的平台来提供这些服务项目的支持,这也是医疗器械注册行业未来的大趋势。
因此,需要一方面利用好大数据及AI技术,把全球生物医药(包括医疗器械)资源线上化,打造专业的数字化创新服务平台,通过供需双方企业的数字化画像和需求预测模型的构建,实现器械企业注册服务需求的精准匹配,帮助供需双方快速找到对方;另一方面通过打造专业的运营团队,帮助供需企业线下精准对接,实现全流程品控。通过线上线下相结合的服务模式,帮助医疗器械企业在注册方面实现降本提效、加速创新。
另外,随着医疗器械注册人制度的全面实施,企业可以通过委托研发或生产的方式(即CDMO)获得注册证和生产许可证。结合能够服务全生命周期的数字化服务平台和线下专业运营的服务对接,形成专业化创新设施与平台的一体化服务,未来将大幅降低企业的注册成本、缩短拿证时间、加速上市周期,为整个行业的创新发展起到推动作用。
我国医疗器械法规体系的构建始于2000年《医疗器械管理条例》的实施,经过2014年、2017年的2次修订后,法规体系的框架已经基本确立。......
广州安思泰企业管理咨询有限公司是一家专业从事国内医疗器械行业注册咨询公司,为客户提供专业的咨询服务,公司奉行“围绕法规、标准,专业服务客户,......
根据《中华人民共和国政府信息公开条例》有关规定,结合2021年度国家药品监督管理局食品药品审核查验中心信息公开实际,编制本年度报告。报告内容......
进行医疗器械备案需要满足一系列的条件,包括申请人的资质、产品信息和资料、产品质量和服务体系、备案流程和要求等,以确保医疗器械的质量和安全性,......
......
广东省药品监督管理局 通 告 2022年 第16号 为贯彻落实我省新冠肺炎疫情防控政策,切实做好医疗器械企业及其从......
广州安思泰企业管理咨询有限公司目前公司已服务800多家客户。公司的服务得到客户的一致好评,并且成为了长期的合作伙伴。为医疗器械生产企业、经营......
根据《医疗器械监督管理条例》规定,凡是在中华人民共和国境内研发、生产、销售医疗器械都需取得相关上市证件方可。......
......
一类医疗器械产品必须依法取得产品备案和生产备案后方可进行生产、销售活动。......