在线客服
在线客服

各有关医疗器械企业:
2017年1月19日,国家食品药品监督管理总局发布了YY/T 0287-2017 / ISO 13485:2016《医疗器械 质量管理体系 用于法规的要求》标准,并于2017年5月1日实施。新版标准强调更加强调法规要求和风险管理,强调法规要求和质量管理体系要求的全面融合,进一步保证了医疗器械生命周期的安全有效。2014年发布了新的医疗器械监督管理条例和配套的行政规章例如医疗器械注册管理办法、生产监督管理办法、经营监督管理办法等,新法规加强了医疗器械企业质量管理体系的要求,除要求企业建立文件化的质量管理体系外,还要求定期提供内审自查报告。如何建立一个适宜的、有效的、满足法规要求并适应国际质量管理标准的质量管理体系,如何进行自查是许多企业面临的一个艰巨任务和课题,为帮助企业解决上述问题,满足产品申请注册和日常监督检查的需要,帮助已获得ISO 9001、ISO 13485认证的企业培养精通新标准、掌握审核技巧的内部审核员,为贵公司体系的转换及审核做好充分的准备,CMD作为CFDA制定YY/T0287(ISO13485)标准的起草和培训单位,特举办YY/T0287-2017 / ISO13485:2016和GB/T19001-2016 / ISO9001:2015标准内审员培训班。
现将有关报名事项通知如下:
一、 主办单位
北京国医械华光认证有限公司(简称CMD)
二、 适用对象
管理者代表、各部门负责人、产品注册人员、体系专员、工艺工程师、检验员以及医疗器械行业监管人员。
三、培训内容
1、 质量管理体系相关标准简介及其基础术语;
2、 YY/T0287-2017 标准详解;
3、 GB/T19001-2016标准讲解;
4、 质量管理体系建立及文件的编写;
5、 内审程序、方法、技巧和内审自查报告。
6、医疗器械生产质量管理规范(GMP)
四、培训费用
1900元/人,(含培训费、资料费、证书费、文具及午餐费等)其它食宿费自理。
五、培训老师
北京国医械华光认证有限公司委派具有国家注册高级审核员资质的讲师授课。
六、证书 由北京国医械华光认证有限公司(CMD)颁发内审员证书(证书内容增加医疗器械生产质量管理规范)(证书有效期三年)
七、培训时间
培训时间: 2019年6月3日至6月6日,共计4天。
2019年6月3日上午8:30—10:00报到,报到完后接着上课。
八. 联系方式
1、办公室地址:广州市越秀区环市东路500号幸运阁8H
2、联系人:沈志珍18002215355 020-37612501 QQ:164345691
九.培训地址和路线
培训地址:广州大道北1995号(怡莱酒店)
乘 车:地铁3号线同和站下车(C出口)直行大约150米交通岗对面。
公交车:862、862B、219、126、833、56、B6、179、82、836东坑站下。
十、收款账户
方 式:通过银行或网上电汇,汇款一定要写清楚汇款单位,并注明培训费字样。
名 称:北京国医械华光认证有限公司
开户行:光大银行北京德胜门支行(只接受公司转账,个人转账不予开发票)
账 号:083501120100304034260(发票抬头与汇款单位相同,个人转账不予开发票)
地 址:北京市东城区安外大街甲88号中联大厦5层
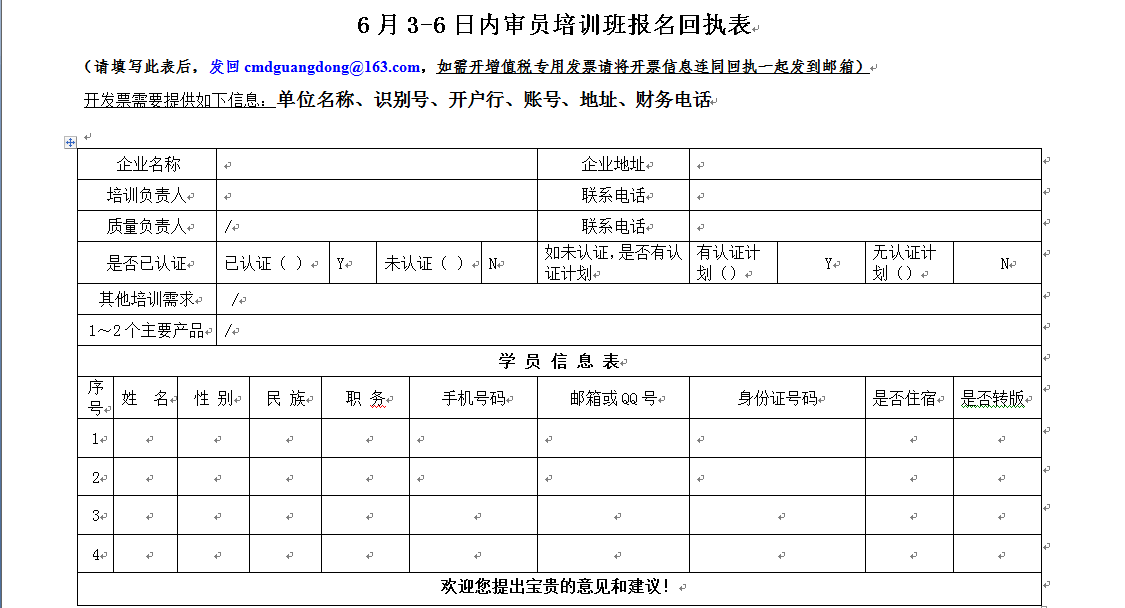
注:如参加培训请报名和汇款,并把汇款单复印件、参加人员信息回执(见附件格邮箱)
北京国医械华光认证有限公司(CMD)广州办公室
2019年4月29日
怎样办理医疗器械许可证一类,二类,三类?第一类医疗器械是风险程度低、实行常规管理可以保证其安全有效的医疗器械,比如手术刀、手术剪、手动病床、......
感谢客户的认可,与我司签订手动轮椅车注册和生产许可证业务合同,我司按照法律法规要求专业辅导客户在短时间内拿到产品注册证和医疗器械生产许可证。......
......
......
......
飞行检查像极了器械生产企业的考试,即使你与判卷人拿着同一份《生产质量管理规范》,还是不确定自己的理解与判卷人的给分标准之间到底差了几个“一般......
我司顺利为广州客户拿到三类医疗器械经营许可证。......
根据《医疗器械监督管理条例》第七十六条规定,国家药监局审核批准《贴敷类医疗器械中17种化学药物识别及含量测定补充检验方法》,现予发布。 ......
2019年5月我司顺利与天河区客户签订了二、三类经营许可证(包含体外诊断试剂,植入介入类)的项目......
热烈祝贺天河区客户取得第三类医疗器械经营许可证......